2019学年上理工附中
高中三年级化学期中考试试题(2019.11)
考生注意:
1、试题满分100分,考试时间60分钟。
2、答卷前,务必在答卷纸(卡)上填写名字、学号等信息。选择题的作答需要涂在答卷卡相应的地区,其余各大题的作答需要写在答卷纸上与试题题号对应的地方,不然一律不能分。
可可以用到的相对原子水平:H-1 C-12 N-14 O-16 Al-27 S-32 Cl-35.5
1、选择题(本题共40分,每小题2分,每题只有一个正确选项)
1. 工业上制取很多的乙烯和丙烯常使用( )
A.催化裂化 B.减压分馏 C.裂解 D.常压分馏
2.只表示一种微粒的化学用语是 ( )
A. ![]() B. X:X C. ns1 D. X—X
B. X:X C. ns1 D. X—X
3. 将SO2气体通入下列溶液中,察看不到明显现象的是( )
A.BaCl2溶液 B.石蕊溶液 C.酸性KMnO4溶液 D.氢硫酸
4. 重水是要紧的核工业材料,下列说法错误的是( )
A.氘原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子水平相同
5.国内古时候的有关典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一是
4Ag+2H2S+O2→2Ag2S+2H2O。下列有关该反应的说法正确的是
A.O2发生氧化反应 B.Ag是氧化剂 C.Ag得到电子 D.O2被还原
6. 1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示
正确的是
A.C+O2 → CO2-393kJ B.C+O2 → CO2+393kJ
C.C+O2 → CO2+393kJ D.C+1/2O2 → CO+393kJ
7. 常温下0.1 mol/L NH4Cl溶液的pH最接近于
A. 1 B. 5 C. 7 D. 13
8.某有机物X的结构简式如右所示,下列说法错误的是
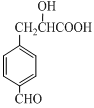 A.能发生聚合反应
A.能发生聚合反应
B.能发生消去反应
C.1mol X最多消耗5 mol H2
D.1mol X最多消耗2 mol Na
9.短周期元素W、Q、X、Y在元素周期表中的地方如右图,其中X是两性金属元素。则
|
| W | Q |
X |
|
| Y |
A.简单离子半径:X
B.气态氢化物的稳定性:Y> Q
C.X的族序数大于周期数
D.Y氧化物对应水化物是强酸
10.常温下,在等体积 ①pH=1的硫酸 ②0.01mol·L-1NaOH溶液
③pH =10的纯碱溶液中 水电离程度的大小顺序是( )
A、①>②>③ B、②>①>③ C、③>①>② D、③>②>①
11.下列有机物按系统命名法正确的是( )
A.2,2-二甲基-3-乙基丁烷 B.2-甲基-3-戊烯
C.2-甲基-2-丙醇 D.2-甲基-2-丁炔
12. 下列实验设计正确的是( )
| 操作 | 现象 | 结论 |
A | 将SO2通入溴水 | 溴水褪色 | SO2具备漂白性 |
B | 将乙烯通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 乙烯具备还原性 |
C | 将澄清石灰水滴入某溶液 | 出现白色浑浊 | 其溶液中存在CO32- |
D | 将硝酸银溶液滴入某溶液 | 出现白色沉淀 | 其溶液中存在Cl- |
13.将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是( )
A.NaOH、NaCl、NaAlO2 B.KNO3、NaCl、CH3COONa
C.Na2S、2SO3、AgNO3 D.KNO3、Na2SO3、NH4HCO3
14. 最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2 +6H2O ![]() 4NH3 +3O2 – Q ,假如反应的平衡常数K值变大,该反应( )
4NH3 +3O2 – Q ,假如反应的平衡常数K值变大,该反应( )
A.化学平衡肯定向正反应方向移动 B. 化学平衡肯定向逆反应方向移动
C.在平衡移动时正反应速率增大逆反应速率减小
D.在平衡移动时正反应速率增大逆反应速率不变
15.下列与化学键有关的叙述正确的是
A.只含离子键的化合物才是离子化合物
B.化学键存在于原子之间,也存在于分子之间
C.因为I—I键的键能比F—F、Cl—Cl、Br—Br的键能都小,因此在卤素单质中I2的熔、沸点最低
D.在共价化合物中肯定没有离子键,而在离子化合物中可能存在共价键
16. NA为阿伏伽德罗常数,下列说法正确的是( )
A.在反应中消耗0.1molCl2,转移的电子数肯定为0.2NA
B.15gCH3+(碳正离子)中含有些电子数为8NA
C.标准情况下,11.2L乙炔中含共用电子对的数目为1.5NA
D.0.1L 2mol/L的2S溶液中含有些S2-数目为0.2NA
17.用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是( )
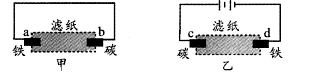
A.甲是原电池,乙是电解池 B.甲中铁棒比乙中铁棒更易腐蚀
C.d电极上的电极反应是:Fe-2e → Fe2+
D.b电极上的电极反应是:O2 + 2H2O + 4e → 4OH-
18.下列实验设计及其对应的离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+→Cu2++2Fe2+
B.Na2O2与H2O反应制备O2:Na2O2+H2O→2Na++2OH-+O2↑
C.将氯气溶于水制备次氯酸:Cl2+H2O→2H++Cl-+ClO-
D.铁与盐酸反应:2Fe + 6H+ → 2Fe3+ + 3H2↑
19. 现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ③溴化钠和单质溴的水溶液,离别以上各混合液的正确办法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
20. 某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉没有明显现象。为确定该溶液的组成,还需检验的离子是( )
。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉没有明显现象。为确定该溶液的组成,还需检验的离子是( )
A.![]() B.
B.![]() C.
C. ![]() D.
D.![]()
2、综合测试(本题共60分)
海水中含有丰富的资源,其中包含钠离子、氯离子、镁离子等。
21.氯元素坐落于元素周期表第________列,写出氯原子的最外层电子排布式________________, 最外层电子所占据的轨道数为________ 个,氯原子核外共有________种能量不一样的电子。
22.列举能说明Mg的金属性比Na弱的一个实验事实________________________________________________________________________________________________________________________________________________________
23.相同压强下,部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/℃ | 1266 | 1534 | 183 |
试讲解上表中熔点SiF4远低于NaF是什么原因________________________________________
_____________________________________________________________________________
氨水是实验室最常见的弱碱
24.向滴有少量酚酞试液的稀氨水,加入少量的NH4AC晶体,若察看到________________则可证明一水合氨是弱电解质。
请再提出一个能证明一水合氨是弱电解质的实验策略 ______________________________
______________________________________________________________________________
25.向盐酸中滴加氨水至过量,该过程所发生反应的离子方程式为 ______________________________________________________________________________
在滴加的整个过程中离子浓度大小关系可能正确的是
a.c=c>c=c b.c>c= c >c
c.c>c>c>c d.c>c>c>c
碳热还原氯化法从铝土矿中炼铝具备步骤简单、材料借助率高等优点,其原理如下:
Ⅰ. Al2O3 + AlCl3 + 3C ![]() 3AlCl + 3CO – 1486 kJ
3AlCl + 3CO – 1486 kJ
Ⅱ. 3AlCl ![]() 2Al + AlCl3 + 140 kJ
2Al + AlCl3 + 140 kJ
26.写出反应Ⅰ的化学平衡常数表达式K=_____________,升高温度,K_______(填增大、减小、不变)。
27. 写出反应Ⅱ达到平衡状况的一个标志_________________________________;
结合反应Ⅰ、Ⅱ进行剖析,AlCl3在炼铝过程中有哪些用途可以看作___________。
28.将1mol氧化铝与3mol焦炭的混合物加入2L反应容器中,加入2mol AlCl3气体,在高温下发生反应Ⅰ。若5min后气体总水平增加了27.6g,则AlCl的化学反应速率为_________ mol/。
29. Na2O2具备非常强的氧化性。少量Na2O2与FeCl2溶液能发生如下反应:
____Na2O2+__________FeCl2+___H2O→____Fe3↓+_____FeCl3+____NaCl
已知FeCl2前面系数为6,配平上述化学方程式,并标出电子转移方向和数目。此反应中被还原的元素是____________,氧化产物是__________。
(三)(本题共14分)实验室模拟合成硫酸的步骤如下:

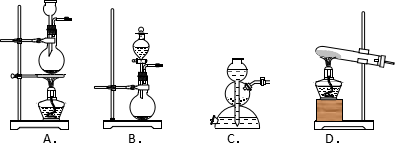 从下图中选择制取气体的适合装置:
从下图中选择制取气体的适合装置:
30.装置C的名字为__________,实验室一般用装置C制备__________。
A.H2 B.C2H2 C.CO2 D.NH3
31.实验室用装置D制备O2的化学方程式为__________。
32.若用装置B制备SO2,可以使用试剂为__________。
A.浓硫酸、亚硫酸钠固体 B.浓硫酸、铜片
C.稀硫酸、亚硫酸钠溶液 D.浓硫酸、铁屑
33.SO2和O2通过甲装置(内部液体为浓硫酸),甲装置有哪些用途除去可以控制SO2、O2的流速外,还可以__________、__________。
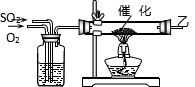 34.用乙处导出的有关气体制成硫酸,下列a、b、c
34.用乙处导出的有关气体制成硫酸,下列a、b、c
三套装置中你选择的是__________,该套装置与
其它装置比较,其优点是__________
![]() __________。
__________。

二
二
二
总分
得分
2、填空题(本题共60分)
(一)(本题共15分)
21.第__________列,最外层电子排布式__________, 轨道数为__________个,共有__________种能量不一样的电子。
22.列举能说明Mg的金属性比Na弱的一个实验事实__________
________________________________________________________________________。
23试讲解上表中熔点SiF4远低于NaF 是什么原因_____________________________________
__________________________________________________________________________。
24.若察看到____________________则可证明一水合氨是弱电解质。
请再提出一个能证明一水合氨是弱电解质的实验策略_____________________________
___________________________________________________________________________。
25.向盐酸中滴加氨水至过量,该过程所发生反应的离子方程式为______________________________
在滴加的整个过程中离子浓度大小关系可能正确的是__________
(二)(本题共15分)
26.平衡常数表达式K=_______________,升高温度,K_______(填增大、减小、不变)。
27.标志_________________________________;AlCl3有哪些用途可以看作___________ 。
28.则AlCl的化学反应速率为______________ mol/。
29. ____Na2O2+__________FeCl2+___H2O→____Fe3↓+_____FeCl3+____NaCl
已知FeCl2前面系数为6,配平上述化学方程式,并标出电子转移方向和数目。
此反应中被还原的元素是____________,氧化产物是__________。
(三)(本题共15分)
30.装置C的名字为__________,实验室一般用装置C制备__________。
31.实验室用装置D制备O2的化学方程式为__________
32.若用装置B制备SO2,可以使用试剂为__________。
33.甲装置有哪些用途除去可以控制SO2、O2的流速外,还可以________________________________________、____________。
34.下列a、b、c三套装置中你选择的是__________,
该套装置优点是__________。
(四)(本题共15分)
35. B的结构简式为________________, 其含有些官能团名字为_______________。
36. 反应①的化学方程式为_____________________________,其反应种类为________。
37. 检验C3H5Cl中含有Cl原子的办法___________________________________________
__________________________________________________________________________。
38. C的结构简式为______________。
39. 反应④的化学方程式为__________________________________________。
40. 设计一条由乙烯为材料制备D的合成路线(其他无机材料任选)。合成路线步骤图示比如下:
![]()
__________
________________________________________________________________________
________________________________________________________________________






